M2-PK
M2-PK,
forma dimérica da isoenzima piruvato quinase, é um útil marcador
tumoral metabólico, que ocorre tanto numa forma tetramérica, que
mostra alta afinidade pelo substracto fosfoenolpiruvato, como na
forma dimérica, que tem baixa afinidade pelo fosfoenolpiruvato. A
M2-PK é uma enzima citolítica.
M2-PK
expressa-se em células diferenciadas como pulmonares, tecido
adiposo, retina, ilhotas pancreáticas, bem como nas células com
altas taxas de síntese de ácidos nucleicos tais como células
normais muito proliferativas, células embrionárias e especialmente
células tumorais
A
forma dimérica predomina nos tumores e denomina-se M2-PK tumoral.
A
forma dimérica é hiperexpressada em muitos tumores, provavelmente
devido a diferentes necessidades metabólicas mostradas pelas células
tumorais, dada a aumentada síntese de ácidos nucleicos, aminoácidos
e fosfolípidos.
M2-PK
é de grande valia na detecção de recaídas e metástases. M2-PK
determina a actividade tumoral que por sua vez dá uma indicação
fiável da agressividade do tumor.
Testes
fecais baseados em marcadores tumorais podem oferecer uma boa escolha
de screening, não invasiva, para cancros colorrectais e pólipos,
bem como no despiste de DII.
Dada
a grande frequência de cancros colorrectais, e dado a sua
morbilidade e mortalidade altas, sendo estas tanto mais elevadas
quanto mais tardiamente for feito o diagnóstico, um teste capaz de
despistar tanto mais precocemente o cancro colorrectal é importante.
A
pesquiza de sangue oculto é um teste com limitações no screening
dos cancros colorrectais, pelo que é conveniente encontrar um teste
com melhor capacidade dada a baixa sensibilidade na detecção de
lesão pré-cancerosa ou mesmo cancerosa. Assim, testes em fezes,
tanto no campo de marcadores fecais baseados no DNA, como em
marcadores proteicos, foram desenvolvidos.
M2-PK
é um teste baseado na detecção das proteínas fecais derivadas dos
colonócitos neoplásicos.
M2-PK
é uma isoforma da enzima glicolítica piruvato quinase encontrada em
tecidos proliferativos com alta capacidade de síntese de ácidos
nucleicos, como sucede com as células tumorais.
Para
um cut-off de 4 U/ml de M2-PK, verifica-se uma sensibilidade para
despiste de cancro colorrectal da ordem dos 68%, valor este superior
ao obtido pelo despiste do sangue oculto bem como de testes fecais
baseados no DNA.
O
cancro do cólon foi detectado com uma sensibilidade de 85%, muito
superior à do cancro rectal que apenas tem uma sensibilidade da
ordem dos 56%.
A
sensibilidade varia com o estadio Duke, sendo superior no estadio D e
inferior no estadio A.
A
sensibilidade corrigida para o cancro colorrectal é de 79% a um
cut-off de 4 U/ml.
A
falta de associação entre importantes factores de risco para o
cancro colorrectal e níveis aumentados do marcador M2-PK sugere que
este marcador não é um marcador de risco de cancro colorrectal mas
a libertação do M2-PK tumoral no intestino apenas aumenta quando
lesões neoplásicas já estão presentes. É pois um marcador de
lesão e não de risco.
M2-PK
é uma subforma enzimática que se desenvolve durante o metabolismo
das células tumorais. É libertado no sangue e fezes do doente.
Piruvato
quinase joga um papel central em todas as células no metabolismo da
glicose. Dado a divisão celular das células tumorais ser maior do
que a das células normais, aquelas necessitam de maior quantidade de
energia do que as células normais. Desta forma, as células tumorais
tomam um desvio metabólico que lhes permite uma poupança de energia
e cria a subforma específica M2 do piruvato quinase. M2-PK é assim
um marcador tumoral produzido pelas células tumorais e lançado no
sangue ou outros fluídos corporais, e cujo aumento de concentração
aponta para existência de tumor.
M2-PK
pode ser doseado no sangue ou, preferencialmente, nas fezes.
De
frizar que o resultado laboratorial de M2-PK é uma indicação e não
um diagnóstico, uma indicação de que uma colonoscopia tem forte
indicação de ser efectuada. O M2-PK pode indicar que um tumor está
presente mas pode também significar a presença de um inofensivo
estado primário tumoral, como é o de um tumor adenóide.
M2-PK
é um marcador utilizado no diagnóstico diferencial de DII em
relação a síndrome de cólon irritável.
A
isoforma M2, dimérica, do piruvato quinase ( M2-PK ) está elevada
nas amostras fecais de doentes com cancro colorrectal.
Verificou-se
valores de M2-PK significativamente elevados em doentes com colite
ulcerosa, doença de Crohn e cancro colorrectal comparativamente com
o síndrome de cólon irritável ou indivíduos sadios.
Há
uma forte correlação de M2-PK com níveis de calprotectina fecais.
Um cut-off de 3.7 U/ml para M2-PK apresenta valores de sensibilidade,
especificidade e valor preditivo positivo de 73%, 74% e 89%,
respectivamente, para existência de doença orgânica. Além disso,
níveis de M2-PK eram significativamente elevados em doença activa,
comparativamente com fase inactiva da doença de Crohn ( 30 U/ml vs
0.55 U/ml ) e colite ulcerosa ( 40 U/ml vs 1.2 U/ml ).
Podemos
concluir que M2-PK fecal está elevado na DII, bem como no cancro
colorrectal, e é um marcador sensível e específico para doença
orgânica gastro-intestinal com um valor preditivo positivo da ordem
dos 89%.
A
detecção de M2-PK não depende do sangue nas fezes e relaciona-se
especificamente com alterações no metabolismo tumoral.
M2-PK
parece ser um bom teste de screening em grande escala para carcinoma
colorrectal. Pode também ser utilizado para detectar adenomas
maiores.
M2-PK
também é um método eficaz na detecção de DII, seja doença de
Crohn ou colite ulcerosa. Os níveis elevados de M2-PK nestes doentes
com DII podem dever-se, muito provavelmente, à proliferação das
células epiteliais e leucócitos nas áreas inflamadas.
O
teste M2-PK nas fezes permite detectar cancros colorrectais
sangrantes ou não sangrantes, bem como pólipos, com elevada
sensibilidade e especificidade.
O
marcador tumoral M2-PK é um forte marcador de metástases mas não
um marcador de um órgão específico.
Níveis
aumentados de M2-PK observam-se em tumores de vários órgãos, como:
- cancro gástrico
- cancro pancreático
- cancro colorrectal
- cancro pulmonar ( neste cancro M2-PK é superior ao NSE )
- melanoma
- cancro da mama
- cancro renal
- cancro cervical
- cancro da próstata
- cancro do esófago
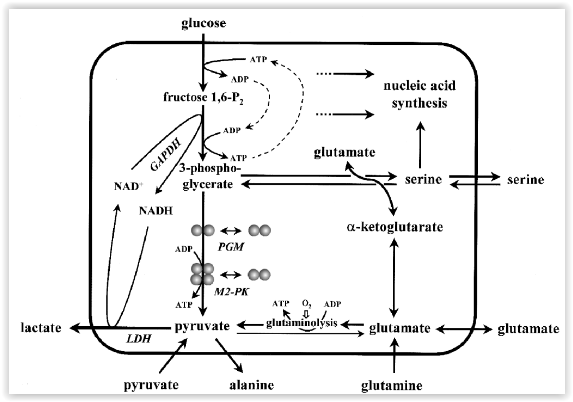
Enquanto
a forma tetramérica de M2-PK é altamente activa a concentrações
fisiológicas de fosfoenolpiruvato e permite uma eficaz conversão de
glicose a lactato com a consequente produção de energia, já na
forma dimérica do M2-PK esta tem uma baixa afinidade pelo
fosfoenolpiruvato sendo praticamente inactiva e dada ser a forma
prevalente nas células tumorais, verifica-se nesta situação
tumoral que os fosfometabolitos a jusante do piruvato quinase se
acumulam e são canalizados para o processo sintético de ácidos
nucleicos, fosfolípidos e aminoácidos, importantes constituintes
das células altamente proliferativas como as tumorais.
O
metabolismo das células tumorais, e outras células proliferativas,
é consideravelmente diferente do metabolismo das células normais.
Para além de outras alterações caractarísticas de tumor, as
células neoplásicas mostram uma hiperregulação da glicólise e
glutaminólise, enquanto a gluconeogénese está reduzida ( nas células tumorais a lise da glucose está aumentada, a produção da glucose está diminuída ).
A
taxa aumentada de glicólise é importante para as células tumorais
por várias razões: energia pode ser provida sem consumo de oxigéneo
e intermediários da glicólise são usados como precursores para a
síntese dos materiais constructores dos nucleotídeos, aminoácidos,
fosfolípidos e triglicerídeos. A regulação destas alterações
metabólicas depende da mudança no equipamento da isoenzima piruvato
quinase. Isoenzimas específicas do tecido, como L-PK do fígado e
rim, M1-PK do músculo e cérebro e R-PK do eritrócito, desaparecem
e M2-PK é expressado, sendo que esta isoenzima M2-PK, ao contrário
de todas as outras que aparecem em forma tetramérica, aparece tanto
na isoforma tetramérica como dimérica, sendo que aquela tem forte
afinidade pelo fosfoenolpiruvato e este tem fraca afinidade por este
substracto.
Oncoproteínas
controlam a razão tetrâmero/dímero da M2-PK. A isoforma dimérica
prevalece nas células tumorais sobre a isoforma tetramérica.
Níveis
elevados da forma dimérica podem também aparecer em situações não
malignas, como inflamação crónica.
1.
Doseamento de M2-PK em soro
M2-PK
pode aparecer elevado, em doseamentos realizados em soro, para além
de situações tumorais, em doenças reumáticas, nefropatia
diabética, ICC, DII, pancreatite crónica ou aguda, sépsis e
politraumatismo.
M2-PK
nos tumores pancreáticos apresentam similar sensibilidade e
especificidade comparativamente com CA 19.9 e CEA e correlaciona-se
bem com a existência de metástases, o que não se verifica com CA
19.9 nem CEA.
M2-PK
nos casos de carcinoma gástrico, demonstrou-se ser pelo menos
de igual utilidade ao CA 72.4 e a combinação destes dois marcadores
( M2-PK e CA 72.4 ) mostrou-se superior aos resultados de um só
marcador. M2-PK não é um bom parâmetro primário de screening para
o carcinoma gástrico, aliás tal como acontece no carcinoma
pancreático.
A
utilidade do M2-PK no screening do carcinoma esofágico é
ainda pouco estudada mas pode ser de alguma utilidade.
M2-PK
fortemente se correlaciona com colangiocarcinoma mal
diferenciado e/ou doença metastizada e fortemente prevê a
sobrevivência.
Nos
carcinomas colorrectais, M2-PK mostrou-se superior em relação
ao CEA quando não metastizado. Nos cancros colorrectais com
metastização, o CEA provou ser superior ao M2-PK. A combinação de
M2-PK com CEA aumenta a sensibilidade. No entanto nem M2-PK nem CEA
são bons marcadores para screening primário.
De
referir que nenhum marcador é bom como screening tumoral
gastrointestinal, sendo a sua valia principalmente em follow-up da
doença maligna.
2.
Doseamento de M2-PK nas fezes
Ao
contrário destas técnicas em soro de doseamento da M2-PK, a
técnica efectuada em material fecal é uma forma interessante de
screening de tumor colorrectal, superior ao despiste do sangue
oculto nas fezes, apresentando valores de 68.8-91% para a
sensibilidade e uma especificidade da ordem dos 71.9-100%.
Adenomas
cólicos podem também ser detectados pelo M2-PK fecal, dependendo a
sensibilidade do tamanho do adenoma.
Verifica-se
boa correlação entre o M2-PK e o estadio da classificação de
Duke. Valores de M2-PK diminuem com a intervenção cirúrgica bem
sucedida.
M2-PK
fecal não deve ser usado no screening do carcinoma colorrectal em
doentes com DII, uma vez que esta doença inflamatória também faz
subir a concentração do M2-PK fecal.
M2-PK
é um bom teste de screening do tumor colorrectal e um resultado
positivo indica fortemente a necessidade de uma colonoscopia com o
objectivo de diagnosticar um cancro colorrectal.
A
dimerização de M2-PK é induzida pela interacção com diferentes
oncoproteínas, incluindo pp60v-src-kinase, oncogenic fibroblast
growth factor 1 e papilomavirus humano 16E7. A determinação de
M2-PK no sangue é utilizada para estudos de follow-up, falência da
terapêutica, recaída ou sucesso terapêutico.
Os
valores de concentração de M2-PK correlacionam-se bem com a
classificação T bem como com os estadios de Duke.
M2-PK
fecal também é um bom marcador da inflamação intestinal, sendo
útil no diagnóstico diferencial da DII com o síndrome do cólon
irritável.
Verificou-se
haver uma forte correlação de valores entre M2-PK e calprotectina
nos doentes, quer sejam de cancro colorrectal, quer por DII ( colite
ulcerosa ou doença de Crohn ). Também se verifica que na doença
inflamatória intestinal em fase activa, os valores de M2-PK são
significativamente mais elevados do que os que se observam em fase de
remissão.
Verifica-se
existir uma maior diferença nos valores de M2-PK, comparativamente
com a calprotectina, entre as fases activa e inactiva da doença de
Crohn, bem como na colite ulcerosa. Desta forma, podemos considerar
que M2-PK é um biomarcador não invasivo da actividade da doença
inflamatória intestinal. A capacidade, já confirmada da
calprotectina, de previsão de recaída conseguida pelo doseamento da
M2-PK ainda tem de ser estabelecida.
Anexo
1:
Efeito de Warburg:
nas células neoplásicas, é a taxa aumentada de produção
de lactato na
presença de oxigéneo