Homocisteína
Homocisteína é um homólogo da cisteína, que se
diferencia desta, pela cadeia lateral que apresenta um grupo -CH2-
antes do grupo tio ( -SH ). A homocisteína pode também derivar da
metionina pela desmetilação do grupo metil do C terminal.
A determinação da concentração sérica da
homocisteína tem valor na avaliação de doentes com risco
cardiovascular, pode lesar o endotélio vascular e promover a
trombose. Também se associa a doenças neurológicas. Substâncias
como a vitamina B12, ácido fólico ou grupos
metil são essenciais na produção de neurotransmissores, sendo
desta forma de importância fundamental no desempenho de certas
funções mentais, cognitivas e psicológicas.
Dado se verificar
hiperhomocisteinemia quando em presença de baixa concentração de
vitamina B6, B12, ácido
fólico ou grupo metil, a hiperhomocisteinemia é um dado indirecto
de déficit daquelas vitaminas ou grupos metil, e assim de aumento de
risco de doença neurológica.
Hiperhomocisteinemia tem como etiologia :
- factores genéticos
- déficit de vitamina B6, B9 ou B12
- déficit de grupos metilo
Hiperhomocisteinemia pode aparecer por factores
genéticos ou por dieta pobre em ácido fólico, vitamina B12
ou B6 .
A determinação de homocisteína deve ser feita em
amostra obtida por colheita sanguínea após jejum de 12 horas.
Valores de referência:
normal
….................... 5 – 15 μmol/l
moderado
….............. 16 – 30 μmol/l
intermediário
…......... 31 – 100 μmol/l
grave
…..................... > 100 μmol/l
ideal
…....................... 5 – 7 μmol/l
A homocisteína é
responsável por cerca de 15% dos ataques cardíacos e AVC's
15% dos AVC e ataques cardíacos são-lhe secundários
A homocisteína é
abundante em carne bovina, ovos, leite, queijo, farinha branca,
enlatados e alimentos altamente processados.
Hiperhomocisteinemia aumenta para o triplo a frequência de ataques cardíacos
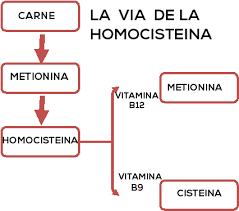
A homocisteína é
um produto da metabolização da metionina e aquela se decompôe em
cisteína ou, por reacção reversa, origina de novo metionina. Tanto
a cisteína como a metionina são substâncias benignas e de valor
essencial para a vida.
Ácido fólico,
vitamina B12
e vitamina B6
são necessárias para aquelas reacções se processarem. A falta de,
pelo menos, uma destas 3 substâncias, origina a subida da
concentração sérica da homocisteína.
Estudos demonstraram
que níveis, mesmo que apenas ligeiramente, elevados, podem fazer
aumentar para o triplo o risco de ataque cardíaco. É esta a razão
pela qual cerca de metade dos doentes que sofreram de ataque cardíaco
apresentam uma concentração sérica normal de colesterol.
O risco
cardiovascular aumenta de forma exponencial nos indivíduos que
apresentam hiperhomocisteinemia associada a hipertensão, colesterol
elevado ou hábitos tabágicos.
Aceita-se
actualmente que a hiperhomocisteinemia se correlaciona com doença
coronária, AVC e patologia vascular periférica. A
hiperhomocisteinemia apresenta acção negativa sobre a saúde
celular e, assim, associa-se a doença de Alzheimer ou demência e,
eventualmente, a depressão, distúrbios oculares e osteoporose.
A suplementação
com vitamina B12,
B6
e ácido fólico é uma medida eficaz na correção da concentração
sérica de homocisteína. Esta suplementação chega a diminuir
15-75% do valor da concentração sérica da homocisteína.
Os níveis séricos
de homocisteína, podem ser reduzidos através de uma dieta com
redução de alimentos ricos em metionina e aumento de produtos como
fruta, proteínas vegetais e legumes. Bife de fígado, salmão ou
marisco, por aumentarem a ingestão de vitamina B6
e B12,
são altamente indicados com esta finalidade.
Hiperhomocisteinemia, que tem uma acção negativa sobre a saúde celular, associa-se a doença de Alzheimer, demência, depressão, distúrbios oculares e osteoporose, entre outras patologias
A homocisteína é
um subproduto da reacção que transforma a metionina em cisteína,
sendo que aquele subproduto aparece em presença de diminuída
concentração de vitamina B6, B12,
ácido fólico e grupos metil.
A homocisteína
elevada, para além de surgir em situação de diminuição de
concentração sérica de ácido fólico, vitamina B12,
vitamina B6 ou grupo metil, também pode aparecer
em situações de hipotiroidismo, doença renal, psoríase ou como
efeito lateral de alguns medicamentos.
A hiperhomocisteinemia pode aparecer em situações de hipotiroidismo, doença renal, psoríase, efeito leteral de alguns medicamentos, ingestão de álcool ou café e hepatopatias
Idosos e vegans são
grupos que apresentam maior risco de hiperhomocisteinemia, dado que
os idosos se alimentam mal e apresentam problemas de absorpção das
vitaminas envolvidas, e os vegans praticam uma alimentação pobre
nestas vitaminas.
Também, na
população em geral, ingestão elevada de álcool ou café aumenta o
risco de hiperhomocisteinemia, bem como o uso de drogas, gastropatias
ou doenças intestinais ( DII por exemplo ) e hepatopatias.
Discute-se se a
homocisteinemia é um agente da doença ou apenas um indicador de
deficiência de nutrientes, estes sim factores de doença.
A homocisteína,
derivado da metionina hepática, sofre metabolização nas vias de
desmetilação e transulfuração de modo que a sua concentração
sérica e urinária é reflexo da síntese celular. A homocisteína
plasmática se encontra na forma oxidada, sob a forma de dissulfetos,
contendo enxofre, que incluem homocisteína, apresentando-se como
dímeros de homocisteína, e dissulfetos mistos de homocisteína e
cisteína. No plasma aparece 2 - 5% de homocisteína livre, na sua
forma reduzida, e 70 – 80% se liga a proteínas, principalmente
albumina. A homocisteína plasmática total é pois a soma de todas
as homocisteínas livres e ligadas a proteínas que apresentam um
grupo tiol.
O metabolismo da
homocisteína é feito por desmetilação, via esta preferencialmente
ocorrendo em jejum, e por transulfuração que é a via que se
verifica funcionar nas situações de sobrecarga de metionina. Para
se manter constante o meio intracelular, é necessária a passagem de
homocisteína para o meio extracelular. As concentrações de
homocisteína no plasma e na urina refletem a sua síntese celular,
utilização e integridade das vias do seu metabolismo. A metionina é
catabolizada a homocisteína, s-adenosilmetionina e
s-adenosilhomocisteína, a nível hepático.
Metabolismo da homocisteína: - desmetilação ( em jejum )
- transsulfuração ( em sobrecarga de metionina )
O metabolismo da
homocisteína é regulado através da s-adenosilmetionina, folatos e
estado redox.
A
hiperhomocisteinemia pode ter factores causais fisiológicos,
genéticos, nutricionais, hormonais ou causados por drogas.
A base genética da
hiperhomocisteínemia difere consoante a via metabólica em causa.
Assim, a mutação CβS,
que aparece na via da transulfuração, que ocorre nas situações de sobrecarga de metionina, é uma condição autossómica
recessiva que se verifica no cromossoma 21, apresentando 33 mutações
pontuais. Mutação CpG nos exons 3, 6 e 7 podem provocar
hiperhomocisteinemia.
A incidência é
extremamente rara para homozigotia ( 1:200000 ) mas muito mais
frequente para heterozigotia ( 1:70 a 1:2000 ). A actividade
enzimática é variável e apenas menos de 50% da população geral
tem uma homocisteína basal com valores normais e teste de sobrecarga
alterado. A frequência de ocorrência de mutação de CβS
na população geral é de 1% e verifica-se 30 – 40% dos doentes
com doença vascular precoce são heterozigóticos para a mutação
CβS.
A mutação no gene
5-MTHFR ( 5-metiltetrahidofolato redutase ) encontra-se na via da
remetilação ( que se verifica nas situações de jejum ) e localiza-se no cromossoma 1, apresentando 10
mutações, sendo uma termolábil e missesence,
com actividade enzimática inferior a 40% do normal, sendo encontrada
em 50% dos polimorfismos. 8% da população geral é homozigótica
para a mutação 5-MTHFR termolábil. Os níveis de folato apresentam
grande influência nos homozigotos, ocorrendo hiperhomocisteinemia
apenas quando os valores de folato são inferiores a 15.4 nmol/l, e
não ocorre hiperhomocisteinemia nos heterozigotos, excepto nas
situações de falta de folato.
A mutação 5-MTHFR pode coexistir
com a mutação CβS,
factor V de Leiden e mutação do gene ACE.
Pode ocorrer mutação
do gene da MS, enzima que depende da vitamina B12 e que catalisa a
remetilação da homocisteína em metionina que, tal com na via da 5MTHFR, se verifica em situações de jejum. Esta mutação do gene
da MS, associa-se a doença cardíaca isquémica, principalmente em
fumadores.
Os factores
fisiológicos mais importantes na hiperhomocisteinemia são o sexo e
a idade, sendo que os homens apresentam níveis superiores aos das
mulheres em cerca de 21%. Mulheres pós-menopausa apresentam valores
mais altos do que os verificados pré-menopausa. A concentração
sérica aumenta com a idade em ambos os sexos. Distúrbios dietéticos
fazem subir a homocisteinemia.
Hiperhomocisteinemia: mais frequente no sexo masculino
aumenta a frequência com o aumento da idade
diminuição de estrogénios diminui a concentração da homocisteína
aumenta com o hipotiroidismo mas o hipertiroidismo não interfere
Metotrexato e
anti-convulsivantes como fenitoína e carbamazepina, por diminuirem a
concentração do ácido fólico, fazem subir a homocisteinemia.
Também a vitamina B6 diminui com o óxido nitroso e com a teofilina.
A diminuição de
estrogéneos aumenta a homocisteína sérica. Na gravidez,
verifica-se uma diminuição de 50% de homocisteína. Terapêutica
hormonal também faz diminuir a homocisteína, bem como o faz também
o tamoxifeno, usado no cancro da mama. Testosterona não apresenta
efeitos sobre a concentração de homocisteína.
Hipotiroidismo faz
subir a concentração da homocisteína mas o hipertiroidismo
apresenta-se com níveis idênticos aos controlos saudáveis.
A determinação da
homocisteína utiliza como método gold standard a cromatografia
líquida de alta pressão ( HPLC ) com detecção electroquímica.
Deve ser feita esta determinação após um jejum de 12 horas e após
teste de sobrecarga com metionina ( determinação basal de
homocisteína seguida de ingestão oral de metionina em dose de 100
mg/Kg ou 4 g/m²
e nova determinação após 2 e 8 horas ). A sobrecarga de metionina
causa um aumento da síntese de homocisteína, dado haver uma maior
concentração de metionina exposta às células; defeitos de
transulfuração são detectados com maior sensibilidade e este teste
de sobrecarga de metionina é capaz de diferenciar defeitos das vias
de remetilação ou transulfuração. Também indivíduos com o
metabolismo alterado da homocisteína podem ser identificados, apesar
de poderem apresentar níveis plasmáticos em jejum dentro dos
valores referência.
Determinação deve ser feita após jejum de 12 horas e então administra-se sobrecarga de metionina.
O teste da sobrecarga de metionina consegue distinguir as 2 vias
FPIA,
quimioluminescência e o método cromatográfico com detecção de
fluorescência são técnicas com sensibilidade, especificidade,
reprodutibilidade, precisão e padronização muito aceitáveis na
determinação da homocisteínemia.
Hiperhomocisteinemia
pode verificar-se em 5 – 7% da população geral, enquanto que 13 –
47% dos doentes com doença vascular aterosclerótica sintomáticos
apresentam níveis moderados a intermediários.
Relação
da hiperhomocisteinemia e diversas patologias
Doenças
vasculares: verifica-se
existir correlação entre homocisteína e aterosclerose,
tromboembolismo arterial e venoso. A hiperhomocisteinemia e
hiperhomocisteinúria é um factor de risco independente para doença
cardiovascular, trombose e aterosclerose.
Para valores de 10
mmol/l, cada 5 mmol/l de homocisteína sérica apresentam um
acréscimo de risco cardiovascular de 80% em mulheres e 60% em
homens, 50% em AVC e um aumento de 6.8 vezes de doença vascular
periférica
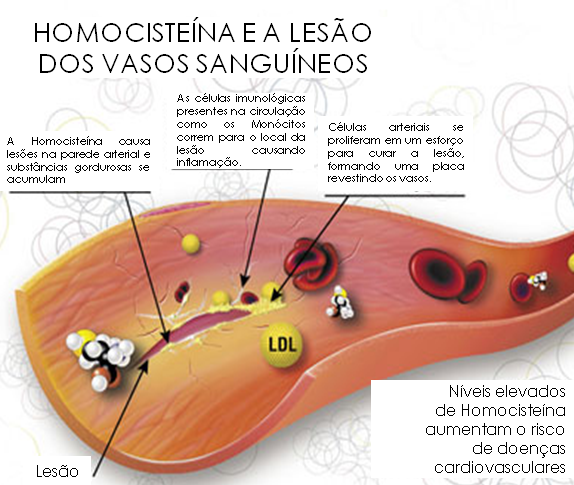
A
hiperhomocisteinemia causa lesão endotelial, crescimento do músculo
liso da parede vascular, aumento da adesividade plaquetária, maior
oxidação da LDL-colesterol com deposição na parede do vaso e
activação da cascata de coagulação. A homocisteína é um
regulador natural leucocitário incluindo a adesão ao endotélio e
migração transendotelial. A homocisteína induz leucócitos e sua
adesão ao endotélio, migração leucocitária transendotelial e
lesão endotelial mediada por leucócitos que muda de forma selectiva
o padrão de expressão da proteína de quimioatracção dos
monócitos ( MCP-1 ) e interleucinas, que por sua vez sinalizam
neutrófilos e respostas celulares com libertação de citoquinas e
agonistas inflamatórios, como α-TNF.
Está
ainda em estudo o papel da homocisteína na doença coronária:
factor de risco ou consequência. Sugere-se a hipótese de uma
concentração moderada de homocisteína sérica seja preditiva de
evento coronário eventualmente secundário a aterosclerose
Doenças
hepáticas: Enzimas
do ciclo da metionina ( via da transulfuração ) são sintetizadas
nos hepatócitos. Por deficiência de CβS,
a hiperhomocisteinemia severa, que se verifica, origina
manifestações clínicas como aterosclerose, trombose, atraso
mental, osteoporose e anomalias esqueléticas, desencadeando o
aparecimento de esteatose hepática onde se observa aumento dos
hepatócitos que apresentam dismorfismos como multinuclearidade e
vacúolos citoplasmáticos com lípidos. A esteatose hepática que
ocorre nas situações de hiperhomocisteinemia surge pelo retículo
endoplasmático, sob stress induzido pela homocisteína, activa a
transcripção dos genes envolvidos no processo de lipogénese e
assim aparece a lesão hepática. Nas hepatopatias
crónicas, o clearance da metionina está aumentado e a homocisteina
apresenta-se diminuída, verificando-se uma menor incidência de
doenças coronárias em cirróticos, pondo-se a hipótese de este
baixo risco de coronariopatia em doentes com hepatopatia crónica se
relacionar com o baixo nível plasmático da homocisteína, mas
outros factores, até agora desconhecidos, deverão estar envolvidos
também. A cirrose apresenta
uma diminuição acentuada de s-adenosil-l-metionina, aumento do
clearance da metionina e hipohomocisteinemia.
Homocisteína
e factor de von Willebrand: O
endotélio, que é o órgão endócrino mais importante do
organismo, apresenta responsabilidade elevada nas doenças
degenerativas e inflamatórias. O factor de von Willebrand é um
processo muito eficiente na avaliação da disfunção endotelial,
tendo uma elevada sensibilidade.
O fvW é secretado
pelas células endoteliais e megacariócitos, sendo aumentada a sua
síntese em casos de lesão ou estímulo das células endoteliais,
podendo ir esse aumento de 2 a 10 vezes.
O fvW liga-se ao
colagéneo, e a outros componentes da parede vascular, sendo um
mediador da adesão plaquetária ao subendotélio vascular lesado.
Num vaso lesado, a matriz de colagéneo é exposta e liga-se ao fvW
circulante no plasma, e este por sua vez se liga às plaquetas
através da glicoproteína GpIb/IX/V que se liga, intracelularmente,
à filamina do citoesqueleto plaquetário.
Pelo menos em
doentes diabéticos, a relação entre a homocisteína e a
aterotrombose não pode ser explicada pela associação entre o fvW e
a homocisteína.
Tratamento de
hiperhomocisteinemia
O tratamento da
hiperhomocisteinemia depende da causa, e a normalização dos níveis
séricos de homocisteína ocorrem dentro de 4 – 6 semanas após o
início do tratamento.
Doentes com defeitos
funcionais graves de MS ou mutação termolábil da 5-MTHFR não
respondem ao tratamento vitamínico, sendo necessário suplemento de
betaína e/ou metionina juntamente com ácido fólico.
Vitamina B6
diminui a concentração de homocisteína no soro apenas em doentes
com deficiência de vitamina B6
ou heterozigotos com deficiência CβS.
Reposição, juntamente com piridoxina isolada, não é capaz de
corrigir a concentração sérica de homocisteína em jejum, e
melhores resultados são obtidos quando o folato é associado.
Vitamina B12,
associada ou não a ácido fólico, também pode ser eficaz no
tratamento da homocisteína elevada sérica.
Ácido fólico,
co-factor importante da metilação da homocisteína, convertendo-a
em metionina, reduz a hiperhomocisteinemia de jejum e após
sobrecarga de metionina, mesmo em doentes com deficiência parcial
de CβS
e 5-MTHFR. Verifica-se uma associação inversa da homocisteína com
o ácido fólico, tanto em doentes como em pessoas saudáveis, sendo
mesmo o único tratamento capaz de ser eficaz em pessoas sadias.
Suplementação de
metionina está indicada nas situações de deficiências da via de
remetilação. Nesta situação, consumo de proteínas pode ter
indicação, no entanto consumo exagerado de proteínas animais ricas
em metionina pode levar à subida de homocisteína, seja em jejum ou
após sobrecarga de metionina, particularmente nos doentes que
apresentam deficiências de piridoxina e concentrações normais de
ácido fólico e vitamina B12.
Conclusões
Hiperhomocisteinemia
e doença arterial, principalmente coronária, tem sido relacionada,
considerando-se que o aumento da concentração sérica da
homocisteína é mesmo um factor de risco para aquela patologia. O
doseamento da homocisteína sérica ajuda na identificação dos
doentes em risco de patologia cardiovascular.