Espectrina
Espectrina
Isoformas de espectrinas são proteínas amplamente expressas nos eritrócitos e outras células.
A
α-espectrina eritróide (
SPTA 1 ) é o componente que predomina no citoesqueleto do
eritrócito. As várias isoformas possuem vários domínios de
interacção, como o SH3 ( Src homologia 3 ), domínio este presente
em proteínas de sinalização ( proteínas tirosina quinase, STAT,
etc.) bem como em proteínas do citoesqueleto, e estes domínios SH3 intermedeiam interacções proteicas ligando-se a sequências curtas,
ricas em prolina, contendo o motif PXXP ( como também existe nas
DNMTs).
A β-espectrina é uma proteína do citoesqueleto eritrocitário com especial importância, pois relaciona-se directamente com a flexibilidade do eritrócito na microcirculação. Defeitos da estrutura da β-espectrina cursam com a esferocitose e eliptocitose hereditárias.
Uma
forma frequentemente utilizada pelo eritrócito, ou outra célula
qualquer, na restrição da mobilidade lateral de proteínas
específicas de membrana é ligá-las a grupos de moléculas de ambos
os lados da membrana. A forma bicôncava do eritrócito resulta das
interacções existentes entre as proteínas da membrana
citoplasmática com o citoesqueleto adjacente, citoesqueleto este que
consiste principalmente de uma rede de proteína filamentosa, a
espectrina.
Interacções
entre as diversas proteínas
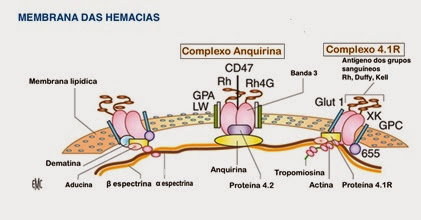
A espectrina é uma proteína filamentosa longa, em forma de bastão flexível, com 100 nm de comprimento. A espectrina é a responsável pela integridade estrutural e forma da membrana plasmática, que é a única membrana do eritrócito visto estas células não terem núcleo nem outros organelos. A rede de espectrina cobre toda a superfície citosólica eritrocitária, de forma flexível, e que permite aos eritrócitos suportarem a pressão exercida na sua membrana, quando passam nos capilares. A falta ou deficiência de espectrina correlaciona-se bem com a aparição de anemia por hemólise, sendo que a severidade da anemia é paralela ao grau de defeituosidade da espectrina.
Membrana
eritrocitária
A espectrina é uma proteína hidrossolúvel de 220-250 kDa, existente nos eritrócitos e demais células. Não contém lípidos ou carbohidratos. A espectrina encontra-se sempre dimerizada, formando uma dupla cadeia, na qual a cadeia α é ligeiramente mais pesada e maior que a cadeia β
Espectrina
α e β
A espectrina, proteína que cobre a parte interna da membrana eritrocitária e outros tipos celulares, adopta disposição pentagonal ou hexagonal, dando suporte estrutural e tendo uma importante função na manutenção da membrana plasmática e da estrutura do citoesqueleto.
Citoesqueleto
As disposições hexagonais são formadas por tetrâmeros de espectrina associados a outros filamentos de actina nos extremos desses tetrâmeros.
Nos vertebrados há
dois tipos de α-espectrina ( α I e α II ) e 5 tipos de
β-espectrinas ( β I a β V ).
A deformabilidade eritrocitária é permitida pela existência de 2 tipos de interacções, sendo uma horizontal entre as diversas proteínas do citoesqueleto, e que proporciona estabilidade global ao eritrócito, e outra vertical entre a espectrina e as proteínas que a ligam à camada bilipídica.
Esferócitos
A eliptocitose congénita caracteriza-se pela presença de eritrócitos ovais ou elípticos, devidos à instabilidade do esqueleto da membrana eritrocitária, provocada pela alteração qualitativa e/ou quantitativa das suas proteínas que impedem a formação de tetrâmeros de espectrina, perdendo o glóbulo vermelho, desta forma, a capacidade de recuperação da sua forma após deformação longitudinal. A causa mais frequente de eliptocitose congénita é a perda de α-espectrina ( 60% dos casos ) seguida da deficiência da proteína 4.1 ( 20 – 30% ), β-espectrina e glucoforina C.
Eliptócitos
A interacção das proteínas do citoesqueleto eritrocitário, com a camada dupla lipídica e com as proteínas transmembrana, fornece a rigidez e integridade que a membrana eritrocitária apresenta.
Distúrbios nestas
proteínas levam a alterações da forma dos eritrócitos, tomando a
forma esférica ou elíptica, e originando uma anemia hemolítica.
Interacções
das proteínas do citoesqueleto com camada bilipidica e proteinas
transmembrana
A espectrina apresenta 5 domínios, partindo do N-terminal, denominados de domínio I, II, III, IV e V. Na cadeia β, os domínios individualizados são denominados de β I a β IV a partir do C-terminal.
As cadeias α e β
são fortemente homólogas e estão associadas de forma
anti-paralela. O agrupamento N-terminal α da cabeça do domínio α-I
fica face ao grupo C-terminal do domínio β-I. Os dímeros de
espectrina associam-se formando tetrâmeros dependendo da força
iónica e temperatura.
Dois tetrâmeros de
espectrina ligam-se, um ao outro, através de curtos filamentos de
actina que formam os “nós” da rede do citoesqueleto do eritrócito.
Ultraestrutura
da membrana eritrocitária
Interacções
proteicas da membrana eritrocitária
Os eritrócitos, por não possuírem núcleo nem organelos, não possuem sistema biossintético de reparação.
O citoesqueleto de
espectrina é uma rede bidimensional situada sob a membrana
citoplasmática eritrocitária.
A função principal
do citoesqueleto de espectrina nos eritrócitos é a de suportar a
camada lipídica, dando-lhe a sua forma bicôncava e a elasticidade
requerida para passar através dos finos capilares sanguíneos. Outra
das funções da espectrina eritrocitária é a de controlar o
acúmulo de algumas proteínas transmembrana, na membrana
eritrocitária durante a eritropoiese.
As espectrinas são moléculas longas e flexíveis, de 200-260 nm de comprimento e 3-6 nm de largura, que existem principalmente como heterotetrâmeros formados por 2 subunidades α e 2 subunidades β, que se unem pelos extremos, numa conformação antiparalela, formando dímeros αβ, associando-se estes dímeros para formarem tetrâmeros. Estes tetrâmeros formam-se pela ligação do extremo amino de cada subunidade α com o extremo carboxílico de cada subunidade β.
Cada subunidade de
espectrina é formada por uma sucessão de motivos, formados por
triplas hélices, denominados repetição de espectrina, que são
domínios de 106 aminoácidos flanqueados por sequências N- e
C-terminais não homólogas. Enquanto as α-espectrinas estão
formadas por 20 repetições de espectrinas ( denominadas α1 a α20
), as β-espectrinas contêm 17 repetições de espectrinas ( β1 a
β17 ) e a βV-espectrina contém 30 repetições de espectrina.
Quando os tetrâmeros
de espectrina se esticam, os filamentos de espectrina alongam-se,
podendo atingir os 200 nm de comprimento.
Para além das
repetições de espectrina, as espectrinas possuem sequências
adicionais que facilitam as interacções com outras proteínas ou
lípidos. As α-espectrinas apresentam um domínio SH3 que se
localiza entre as repetições α9 e α10 que participa na
sinalização celular mediante a interacção com sítios ricos em
prolina.
No C-terminal da
β-espectrina, encontra-se um domínio de homologia plekstrin ( PH;
também aparece este domínio PH nas proteínas tirosina fosfato ).
proteínas α-espectrinas ...... domínio SH3
proteínas β-espectrina ...... domínio PH
Os eritrócitos
humanos apresentam um tipo de tetrâmero de espectrina formado por
uma subunidade αI e uma subunidade βI localizado na parte interna
da membrana plasmática.
O citoesqueleto
eritrocitário de espectrina tem como função o suporte para
propicionar a forma do eritrócito e manter a integridade da membrana
celular e as propriedades mecânicas dessa membrana. Nas células
nucleadas, a espectrina tem acção sobre a arquitectura celular,
mantendo-a, e a morfologia e estabilidade da membrana plasmática das
células. Nas células epiteliais, por deplecção da βII-espectrina,
ou também por deplecção da anquirina G, há perda da membrana
lateral com expansão da área das membranas apical e basal, e
transformação da célula com morfologia de coluna em célula
escamosa.
A βV-espectrina
também assegura flexibilidade às células não eritrocitárias.
Mutações da
espectrina são responsabilizadas por diversas doenças
neurodegenerativas.
O citoesqueleto de
espectrina controla a disposição de alguns canais da membrana,
receptores, transportadores e moléculas de adesão. Defeitos das
espectrinas levam à desestabilização da estrutura da membrana que
originam doenças neurodegenerativas e outras patologias.
A espectrina tem
também acção na regulação do ciclo celular, podendo estar
envolvida na sinalização do β-TGF ( transforming growth factor β
) que tem actuação no crescimento, diferenciação e apoptose
celulares.
A αII-espectrina,
que se encontra também no núcleo celular, pode participar na
reparação do DNA. Doentes com doença de Fanconi não possuem
αII-espectrina.
Depois da lesão
celular se verificar, a αII-espectrina liga-se aos locais
danificados de DNA e contribui para o recrutamento das proteínas
reparadoras. A αII-espectrina também está envolvida no processo
de manutenção da estabilidade cromossómica, pelo que a deplecção
de αII-espectrina leva à instabilidade cromossómica,
verificando-se aberrações da cromatina com diminuição do
crescimento celular e da sua sobrevida.
A α-espectrina,
através do domínio SH3, tem acção sobre a adesão e expansão
celular.
Nas linhagens
celulares derivadas dos linfócitos, a espectrina distribui-se pelo
citoplasma, podendo frequentemente formar agregados.
Via reguladora
importante na remodelação da membrana esquelética é a
fosforilação da espectrina. Verificou-se que a fosforilação da
β-espectrina é essencial para a desestabilização da membrana
esquelética do glóbulo vermelho e controlo da estabilidade do
complexo de Golgi. A αII-espectrina é importante na fosforilação
das tirosinas.
A βIV-espectrina
pode estar envolvida no mecanismo regulador dos canais de sódio Naᵥ
1.5 através da fosforilação da βIV-espectrina por uma quinase-II
dependente do cálcio/modulina.
A espectrina é
essencial para o complexo de Golgi manter, e obter, a sua forma de
cisternas.
proteínas αII-espectrina ...... reparação do DNA
proteínas αII-espectrina ...... instabilidade cromossómica
proteínas βII-espectrina ...... perda da membrana lateral
proteínas βIV-espectrina ...... regulação dos canais Naᵥ 1.5
proteínas βV-espectrina ...... flexibilidade de células que não eritrócitos
espectrina ...... manutenção da forma das cisternas do complexo de Golgi
espectrina ...... β-TGF com acção no crescimento, diferenciação e apoptose celulares
Foram identificados
3 locais de união à membrana citoplasmática, denominadas MAD (
membrane association domain ) nas β-espectrinas ( MAD 1, MAD 2 e
MAD 3 ). O domínio MAD 1 encontra-se no N-terminal e é formado por
domínio ABD e local de união Arp1, o MAD 2 encontra-se no
C-terminal sendo constituído por domínio PH, enquanto o MAD 3 é
constituído pelas repetições de espectrina β3 – β7.
Os domínios MAD 1 e
MAD 2 da espectrina funcionam em conjunto na direcção da
localização subcelular da espectrina.
A fosforilação da
β-espectrina é essencial na desestabilização da membrana
eritrocitária, na desmontagem do citoesqueleto celular durante a
mitose e no controlo da estabilidade do aparelho de Golgi.


.gif)






Sem comentários:
Enviar um comentário